Аммоний темірі (II) сульфаты - Ammonium iron(II) sulfate
 | |
 | |
| Атаулар | |
|---|---|
| IUPAC атауы Аммоний темірі (II) сульфаты | |
| Басқа атаулар Темір аммоний сульфаты Аммоний темір сульфаты Мордың тұзы | |
| Идентификаторлар | |
| |
3D моделі (JSmol ) | |
| Чеби |
|
| ChemSpider | |
| ECHA ақпарат картасы | 100.030.125 |
| EC нөмірі |
|
PubChem CID | |
| UNII |
|
CompTox бақылау тақтасы (EPA) | |
| |
| |
| Қасиеттері | |
| Fe (SO4) (NH4)2(СО4) (сусыз) Fe (SO4) (NH4)2(СО4) · 6H2O (гексагидрат) | |
| Молярлық масса | 284,05 г моль−1 (сусыз) 392,13 г моль−1 (алты қырлы) |
| Сыртқы түрі | Көк-жасыл қатты |
| Тығыздығы | 1,86 г / см3 |
| Еру нүктесі | 100-ден 110 ° C-қа дейін (212-ден 230 ° F; 373-тен 383 К) |
| Қайнау температурасы | Жатпайды |
| 269 г / л (гексагидрат) | |
| Қауіпті жағдайлар | |
| Қауіпсіздік туралы ақпарат парағы | Fisher MSDS |
| GHS пиктограммалары |  |
| GHS сигнал сөзі | Ескерту |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302 + 352, P304 + 340, P305 + 351 + 338, P312, P321, P332 + 313, P337 + 313, P362, P403 + 233, P405, P501 | |
| NFPA 704 (от алмас) | |
| Байланысты қосылыстар | |
Байланысты қосылыстар | Аммоний темірі (III) сульфаты |
Өзгеше белгіленбеген жағдайларды қоспағанда, олар үшін материалдар үшін деректер келтірілген стандартты күй (25 ° C [77 ° F], 100 кПа). | |
| Infobox сілтемелері | |
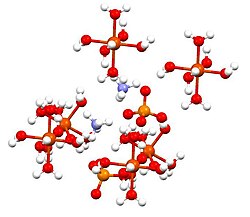
Аммоний темірі (II) сульфаты, немесе Мордың тұзы, болып табылады бейорганикалық қосылыс формуласымен (NH4)2Fe (SO4)2(H2O)6. Екі басқа катиондар, Fe2+ және NH4+, ол а ретінде жіктеледі қос тұз туралы темір сульфаты және аммоний сульфаты. Бұл қарапайым зертханалық реагент, өйткені ол тез кристалданады, ал кристалдар ауамен тотығуға қарсы тұрады. Темір сульфатының басқа тұздары сияқты, темір аммоний сульфаты суда ериді аквокешен [Fe (H2O)6]2+, ол бар октаэдрлік молекулалық геометрия.[1] Оның минералды түрі мохрит.
Құрылым
Бұл қосылыс шениттер немесе деп аталатын қос сульфаттар тобының мүшесі Таттонның тұздары. Таттонның тұздары моноклиндік кристалдар түзеді және М формуласына ие2N (SO4)2.6H2O (M = әртүрлі монокациялар). Байланыстыруға қатысты кристалдар тұрады октаэдра [Fe (H2O)6]2+ сульфат пен аммониймен сутегімен байланысқан орталықтар.[2]
Мордың тұзы неміс химигінің есімімен аталады Карл Фридрих Мор, 19 ғасырда титрлеу әдіснамасында көптеген маңызды жетістіктерге жеткен.
Қолданбалар
Жылы аналитикалық химия, бұл тұз темір иондарының артықшылықты көзі болып табылады, өйткені қатты зат тотығуға төзімді, ұзақ сақталады. Бұл тұрақтылық рН-нің темір / темір тотығу-тотықсыздану жұбына әсерін көрсететін шешімдерге дейін созылады. Бұл тотығу жоғары рН кезінде оңай жүреді. Аммоний иондары Мор тұзының ерітіндісін аздап қышқыл етеді, бұл тотығу процесін баяулатады.[1][3] Күкірт қышқылы әдетте темір теміріне тотығуды азайту үшін ерітінділерге қосылады.
Ол қолданылады Fricke дозаторы гамма сәулелерінің жоғары дозаларын өлшеу үшін.[4]
Дайындық
Мордың тұзын-ның эквимолярлық қоспасын еріту арқылы дайындайды гидратталған темір сульфаты және аммоний сульфаты аз мөлшерде суда күкірт қышқылы, содан кейін алынған нәтижеге бағынады шешім дейін кристалдану. Темір аммоний сульфаты ашық жасыл кристалдар түзеді. Бұл тұз иондарды қыздырғанда ондағы барлық катиондар мен аниондарды береді.
Ластаушы заттар
Кәдімгі қоспаларға жатады магний, никель, марганец , қорғасын, және мырыш, олардың көпшілігі изоморфты болып келеді тұздар.[5]
Пайдаланылған әдебиеттер
- ^ а б Гринвуд, Норман Н.; Эрншоу, Алан (1997). Элементтер химиясы (2-ші басылым). Баттеруорт-Хейнеманн. ISBN 978-0-08-037941-8.
- ^ Эфраим, Фриц (1926). Бейорганикалық химия. tr P. C. L. Thorne. Лондон: Гурни мен Джексон. 484–485 беттер.
- ^ «Аммоний темір сульфаты 100 г (Мор тұзы)». 2012. Алынған 13 маусым 2013.
- ^ Хикман, С .; Лоррейн, С .; Барте, Дж .; Портал, Г. (1986). «Мор тұзын жоғары деңгейлі гамма дозиметриясы үшін қолдану (10-ға дейін)8 Ж)). Радиациялық қорғаныс дозиметриясы. Оксфорд журналдары. 17 (1–4): 255–257. дои:10.1093 / oxfordjournals.rpd.a079818.
- ^ Фогель, Артур И. (1961). Бастапқы аспаптық талдауды қосқандағы сандық бейорганикалық талдаудың оқулығы (3 басылым). Лонгманс. 281–282 бет.

